|
 Teorija Teorija
Sprendžiant šiuos uždavinius,
labai svarbu žinoti, kaip suplanuoti veiksmų seką.
Ji yra tokia:
- Peskaičius
uždavinio sąlygą, būtina išsiaiškinti svarbiausią
klausimą. Iš karto nesupratus, reikia perskaityti dar kelis kartus.
- Užrašyti
reakcijos lygtį bei ją išlyginti.
- Nustatyti,
kas yra duota ir ką reikia rasti.
- Skaičiuoti:
kiekį, masę arba dalelių skaičių (ko reikalauja uždavinio
sąlyga).
- Sudaryti
proporcijas, apskaičiuoti ieškomąjį dydį.
- Būtinai
parašyti atsakymą.
 Formulės
Formulės
Medžiagos
masė: m
= v x
ς,
m
– masė
g kg
Medžiagos tankis: ς
=m : v, ς
– tankis
g/cm3
g/ml g/l
Medžiagos
tūris: v =m : ς,
v
– tūris
1ml = 1cm3
1l = 1dm3
Molio
skaičiavimo formulės:
n = N : N A
n = m : M
n = V : V M
N = n x N A
m = n x M
V = n x V M
Masės
dalis ir tankis:
w(A) =
m(A) :
m(tirpalas ar mišinys)
x 100%
m(A) =
w(A) x
m(tirpalas ar mišinys) : 100%
m(tirpalas ar
mišinys) = m(A) x 100% : w(A)
 Uždavinių sprendimo pavyzdžiai Uždavinių sprendimo pavyzdžiai
Uždavinys
1
|
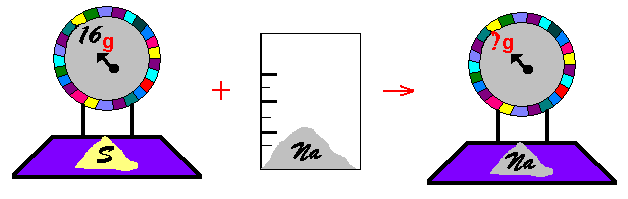
Kokia masė natrio (Na) sureaguos
su 16 g sieros (S)?
2 Na + S → Na2S
|
| Duota: m(S) = 16 g
M(S) = 32 g/mol
Rasti: m(Na)
Formulė: n = m
: M
m = n x M
|
 |
Sprendimas:
-
Randame
sieros molių skaičių:
n(S) = 16 g : 32 g/mol = 0,5 mol
-
Randame
nežinomos medžiagos (Na) molių skaičių:
x mol
0,5 mol
2 Na
+
S
→ Na2S
2 mol
1 mol
Kadangi visi uždavinių daviniai verčiami moliais (masės,
dalelių skaičiai), tai sudaroma proporcija:
| Pagal
reakcijos lygtį reaguojančių molių skaičių
rodo koeficientai |
→
|
2
mol Na
1 mol S 
x mol Na
0,5 mol S
|
x = 0,5 mol x 2 mol : 1 mol = 1 mol Na
-
Randame
Na masę:
n (Na) = 1 mol
M (Na) = 23 g/mol
m (Na) = 23 g/mol x 1 mol = 23 g
Atsakymas:
su 16 g sieros reaguoja 23 g natrio
Uždavinys
2
Kokių masių vario oksido (CuO)
ir vandenilio (H2) reikia, norint gauti 16 g vario?
CuO + H2 → Cu + H2O
Duota: m(Cu) = 16 g
M(Cu) = 64 g/mol
Rasti: m(CuO) ir m(H2)
Formulė: n =
m : M
m = n x M
Sprendimas:
-
Randame
vario molių skaičių:
n(Cu) = 16 g : 64 g/mol = 0,25 mol
-
Randame
vario oksido molių skaičių:
x mol
0,25 mol
CuO + H2
→ Cu
+ H2O
1 mol
1 mol
Pagal reakcijos lygtį: 1 mol CuO – 1 mol Cu
Pagal uždavinio sąlygą: x mol CuO – 0,25 mol Cu
x = 1 mol x 0,25 mol : 1 mol =
0,25 mol CuO
-
Randame
vario oksido masę:
n(CuO) = 0,25 mol
M(CuO) = 64 + 16 = 80 g/mol
m(CuO) = 80g/mol x 0,25 mol =
20 g
-
Randame
vandenilio molių skaičių:
y mol
0,25 mol
CuO + H 2
→ Cu
+ H2O
1
mol
1 mol
1 mol H2 – 1 mol Cu
x mol H2 – 0,25 mol Cu
x = 1 mol x 0,25
mol : 1mol = 0,25 mol H2
-
Randame
vandenilio masę:
n (H2) = 0,25 mol
M(H2) = 1 x 2 = 2
g/mol
m(H2) = 0,25 mol x 2 g/mol = 0,5 g
Atsakymas:
16 g vario gauti reikia 20 g CuO ir 0,5 g H2.
Uždavinys
3
|
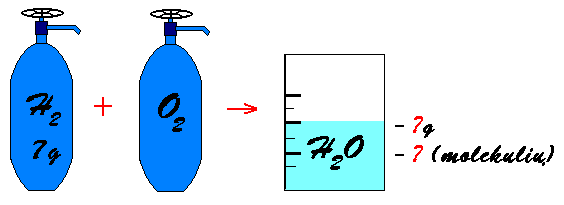
Kiek gramų ir molekulių vandens
susidarė 7 g vandenilio (H2) reaguojant su deguonimi?
2 H2 + O2 →
2 H2O
|
| Duota: m(H2) =
7 g
M(H2) = 2 g/mol
Rasti: m(H2O)
N(H2O)
Formulė: m =
n x M
N = n
x
NA
|
 |
Sprendimas:
-
Randame
vandenilio molių skaičių:
n(H2) = 7 g : 2 g/mol =
3,5 mol
-
Randame
vandens molių skaičių:
3,5 mol
x mol
2H2 +
O2 → 2 H2O
2 mol
2 mol
Pagal reakcijos lygtį: 2 mol H2 – 2 mol H2O
Pagal uždavinio sąlygą: 3,5 mol H2 – x mol H2O
x = 2 mol x 3,5 mol H2 : 2 mol = 3,5
mol
H2
-
Randame
vandens 3,5 mol masę:
m = n x M
m(H2O) = 3,5 mol x 18
g/mol = 63 g
-
Randame
vandens molekulių skaičių:
w = n x wA
wA = 6,02 x 1023
N(H 2 O) =
3,5 x 6,02 x 1023 = 2,107 x 1024
Atsakymas:
iš 7 g H2
gauname m(H2O) –
63 g, N(H2O)
– 2,107 x 1024
Uždavinys
4
|
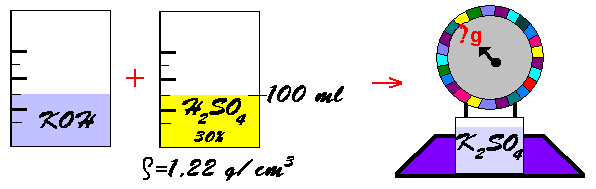
Kiek kalio sulfato susidarys reaguojant
100 ml 30 %
sieros rūgšties tirpalo, kurio ς = 1,22
g/cm3 su kalio šarmu.
2 KOH + H2SO4
→ K2SO4 + 2 H2O
|
| Duota: v(H2SO4) =
100 ml
w(H2SO4) =
30 %
ς(H2SO4) =
1,22 g/cm3
Rasti: m(H2SO4)
Formulė: m = v x ς
m(A) = w(A) : 100 % x m(t)
n = m : M
m = n x M
|
 |
Sprendimas:
-
Randame
30 % H2SO4 masę:
m = v x ς,
m(H2SO4) = 100 ml x 1,22
g/cm3 = 122 g
-
Randame
grynos H2SO4
masę:
m(H2SO4) 100
% = 30 %
: 100 % x 122 g = 36,6 g
-
Randame
H2SO4 molių skaičių:
M(H2SO4) = 98 g/mol
n = m : M;
n (H2SO4)
= 36,6 g : 98 g/mol = 0,37 mol
-
Randame
K2SO4 molių skaičių:
0,37 mol x
2 KOH + H2SO4 → K2SO4
+ 2 H2O
1 mol 1 mol
x = 0,37 mol x 1 mol : 1 mol = 0,37 mol
-
Randame
K2SO4
masę:
M(K2SO4) = 39 x 2 + 32 +
16 x 4 = 174 g/mol
m = n x M
m(K2SO4) =
174 g/mol x 0,37 mol = 64,38 g
Atsakymas:
iš 30 %
H2SO4 ς = 1,22 g/cm3 gausime 64,38 g K2SO4
Uždavinys
5
Kokio tūrio 9
%
sodos (Na2CO3) tirpalo, kurio ς =
1,12 g/ml, reikės reakcijai su
magnio chloridu (MgCl2). Šios reakcijos metu susidarė 0,15
mol magnio karbonato MgCO3.
Na2CO3
+
MgCl2
→MgCO3 + 2 NaCl
Duota: n(MgCO3) =
0,15 mol
w(Na2CO3) =
9 %
ς(Na2CO3) =
1,12 g/ml
Rasti: v(Na2CO3)
Formulė: m(t) = mA
: wA x 100 %
v = m
: ς
m =
n x M
Sprendimas:
-
Nustatome
Na2CO3 molių skaičių:
x mol 0,15 mol
Na2CO3 + MgCl 2 → MgCO3
+ 2 NaCl
1 mol
1 mol
Pagal reakcijos lygtį: 1 mol Na2CO3 – 1 mol
MgCO3
Pagal uždavinio sąlygą: x mol
Na2CO3 – 0,15 mol MgCO3
x = 0,15 mol x 1 mol : 1 mol =
0,15 mol
-
Nustatome
Na2CO3 masę:
n(Na2CO3) =
0,15 mol
M(Na2CO3) = 106 g/mol
m = n x M
m(Na2CO3) = 0,15 mol x 106
g/mol = 15,9 g
-
Randame
9 % sodos tirpalo masę:
m(t) = m(A) : w(A) x 100 %
m(Na2CO3)
= 15,9 g : 9 % x 100 % = 176,7 g
-
Randame
9 % tirpalo tūrį:
v = m : ς
v (Na2CO3)t = 176,7 g : 1,12 g/ml = 157,8
ml
Atsakymas:
reikia 157,8 ml Na2CO3 9 % tirpalo.
 Uždaviniai savarankiškam darbui Uždaviniai savarankiškam darbui
1. Kiek
molių ir gramų ličio oksido (Li2O) susidarys,
reaguojant 1,75 g ličio (Li) su deguonimi (O2)?
Atsakymas
2. Kiek
gramų geležies sulfido (FeS) susidarys, jei reakcijoje dalyvavo
6,4 g sieros (S) ir geležis?
Atsakymas
3. Kokia
masė švino (Pb) susidarys, reaguojant 22,3 g švino oksido
(PbO) su vandeniliu?
Atsakymas
4. Kiek
molių ir gramų deguonies (O2) ir aliuminio (Al) reikės
5,1 g aliuminio oksido (Al2O3) pagaminti?
Atsakymas
5. Kiek
gramų anglies (C) reikės reakcijai su deguonimi (O2), kad
gautume 5,6 g anglies monoksido (CO)?
Atsakymas
6. Kiek
gramų ir molių deguonies (O2) reikės reakcijoje su
anglimi, norint gauti 5,6 g anglies dioksido (CO2)?
Atsakymas
7. Kiek
molekulių sieros reagavo su 9,6 g deguonies (O2) sieros
dioksido (SO2) gavimo procese?
Atsakymas
8. Kiek
gramų, molių ir molekulių susidarys vandenilio Chlorido (HCl),
reaguojant 1,505 x 1023 vandenilio (H2) su chloru (Cl2)?
Atsakymas
9. Kiek
molekulių pradinių medžiagų fosforo (P) ir deguonies (O2) reagavo susidarant 0,4
mol fosforo pentoksido (P2O5)?
Atsakymas
10. Kiek
vandenilio (H2) išsiskirs, reaguojant cinkui (Zn) su 150 ml
15 % druskos rūgšties (HCl), kurios ς = 1,07 g/ml?
Atsakymas
11. Kokia
masė natrio nitrato (NaNO3) susidarys, reaguojant azoto rūgščiai
su 20 ml 0,3 mol/l koncentracijos natrio šarmo tirpalu (NaOH)?
Atsakymas
12. Kokia
masė bario chlorido (BaCl2) reaguoja su 130 ml 14 % natrio
sulfato tirpalu Na2SO4, kurio ς =1,12 g/ml?
Atsakymas
13. Kokio
tūrio druskos rūgšties (HCl) 10 % reiks,
kurio ς =1,05 g/ml reakcijai su natrio šarmu(NaOH), 11,7 g
valgomosios druskos (NaCl) gauti?
Atsakymas
14.
Kokios
masės 1,7
%
sidabro nitrato AgNO3 tirpalo reiks jam reaguojant su aliuminio
chloridu (AlCl3), norint pagaminti 0,207 g sidabro chlorido?Atsakymas
15. Kokio
tūrio 0,1 mol/l bario nitrato (Ba(NO3)2) reikia reakcijai su 3 g kalio karbonato (K2CO3)?
Atsakymas
16. Koks
kiekis moliais (mol) ir masė (g) magnio oksido MgO susidarys, reaguojant
0,3 mol magnio Mg su deguonimi O2?
Atsakymas

|