|
 Teorija Teorija
Medžiagos, turinčios savo sudėtyje
chemiškai prisijungusio vandens, vadinamos hidratais.
Kristale esantis
chemiškai prisijungęs vanduo vadinamas kristalizaciniu vandeniu.
Medžiagų
pavyzdžiai: CuSO4 x 5H2O, MgSO4
x 7H2O, Na2SO4 x
10H2O ir t.t.
Sprendžiant uždavinius su
hidratais, dažniausiai skaičiuojamos: vandens, druskos masės dalys,
junginių molių skaičiai, taip pat bevandenės druskos masė
 Formulės
Formulės
w(H2O) = iMr
(kristalizacinio H2O) : Mr (hidrato) x 100%
i – vandens molekulių skaičius
 Uždavinių sprendimo pavyzdžiai Uždavinių sprendimo pavyzdžiai
Uždavinys
1
|
Apskaičiuokite vandens masės dalį
CuSO4 x 5H2O.
|
|
Duota:Mr(H2O) =
18,
Mr(CuSO4 x
5H2O) = 250
Rasti:
w(H2O)
Formulė:
w(H2O) = iMr(H2O)
: Mr(hidrato) x 100 %
Sprendimas:
w(H2O) = 5 x 18
: 250 x 100 % =
36 %
Atsakymas:
vandens masės dalis –
36 %.
|
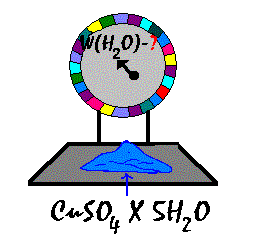
|
Uždavinys
2
|
Apskaičiuokite kiek CuSO4 x
5H2O ir vandens reiks 300 g 5% tirpalui pagaminti.
|
| Duota:m(t) =
300 g,
w(CuSO4) =
5 %
Rasti: m(CuSO4),
m(H 2O)
Formulės:
m = w(A) : 100 % x m(t)
v = m :
ς
Sprendimas:
-
Randame
CuSO4 masę:
m(CuSO4) = 5 % : 100 %
x 300 g = 15 g
-
Randame
hidrato ir druskos molines mases:
M(CuSO4) = 64 + 32 + 16 x 4 = 160 g/mol
M(CuSO4 x 5H 2O) = 160 + 5 (1
x 2 + 16) = 250 g/mol
-
Randame
1 molio hidrato ir druskos mases:
m(CuSO4) = 160 g/mol x 1 mol = 160 g
m(CuSO4 x 5H 2O) = 250 g/mol
x 1 mol = 250 g
-
Apskaičiuojame,
kiek hidratas turi bevandenės druskos:
250 g hidrato – 160 g bevandenės druskos
x g hidrato – 15 g bevandenės druskos
x = 250 g x 15 g : 160 g = 23,43 g
-
Randame
vandens masę:
m(H 2O) = 300 g – 23,43 g = 276,57 g
-
Randame
vandens tūrį:
v(H 2O) = 276,57 g : 1 g/ml = 276,57 ml
Atsakymas:
tirpalui reiks 23,43 g
CuSO4
x 5H 2 O ir 276,57 ml H 2O.
|
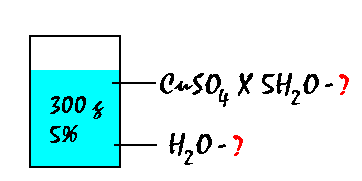
|
 Uždaviniai savarankiškam darbui Uždaviniai savarankiškam darbui
1. Kokia
vandens masės dalis yra FeSO4 x 7H2O?
Atsakymas
2. Kokia
masės dalis vandens yra Na2CO3 x 10H2O?
Atsakymas
3. Kokia
masės dalis kalcio chlorido yra CaCl2 x 6H2O?
Atsakymas
4. Kokia
masės dalis kalcio sulfato yra CaSO4 x 2H2O?
Atsakymas
5. Kokio
tūrio vandens ir bevandenio FeSO4 reiks 300 g 15 % tirpalo iš
FeSO4 x 7H2O paruošti?
Atsakymas
6.
250 g
tirpalo yra 50 g Na2SO4. Kiek reikės
Na2SO4
x 10H2O ir vandens tirpalui paruošti?
Atsakymas
7. Apskaičiuokite
vandens tūrį ir bevandenės druskos masę 400 g 1,5% Na2CO3 x 10H2O
tirpale.
Atsakymas
8. Kiek
molių sudaro 25 g MgSO4 x 7H2O?
Atsakymas
9. Kiek
molių sudaro 45 g CuSO4 x 5H2O?
Atsakymas
10. Kiek
molių vandens yra 125 g CuSO4 x 5H2O?
Atsakymas
11.
Daržoves ir vaisius nuo ligų sukėlėjų apsaugoma
purškiant CuSO4· 5H2O tirpalu. Kokia masė vario
sulfato CuSO4 yra 1 kg hidrato?
Atsakymas

|