Vienos temos
struktūra
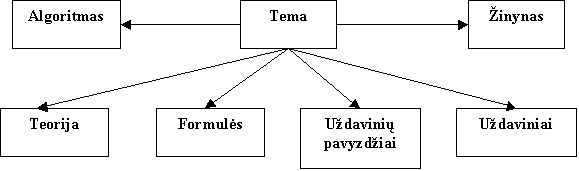
Visų
temų struktūra vienoda. Kiekvienoje temoje yra galimybė perskaityti uždavinių
sprendimo bendrąjį algoritmą, pasinaudoti žinynu bei pateiktomis
teorinėmis žiniomis, formulėmis, uždavinių sprendimo pavyzdžiais,
uždaviniais savarankiškam darbui.
Algoritmas –
aprašoma uždavinių
sprendimo eiga. Ši eiga yra skirtinga skaičiuojant reakcijos lygtis (temos:
reakcijos lygtys, pertekliaus nustatymas ir išeigos skaičiavimas) ir
sprendžiant kitų temų uždavinius.
Algoritmo peržiūrai naudojama nuoroda:
 Uždavinių sprendimo eiga
Uždavinių sprendimo eiga
Toliau pateikiamas algoritmo pavyzdys:
-
Nustatyti pradinius duomenis
(kas duota).
-
Nustatyti galutinius duomenis (rezultatus, ką
reikia
rasti).
-
Parinkti tinkamą (-as) formulę
(-es).
-
Nustatyti tarpinius duomenis (ko dar
reikės uždaviniui išspręsti).
-
Nustatyti būdus (parinkti lenteles, formules) tarpinių duomenų paieškai.
-
Patikrinti, ar suvienodinti naudojamų fizikinių dydžių matavimo
vienetai.
-
Atlikti reikalingus skaičiavimus pagal
formules.
-
Parašyti gautą atsakymą.
Žinynas –
pateikiamos
lentelės, dydžių sąryšiai:
- Periodinė elementų lentelė
- Rūgščių, bazių, druskų tirpumo
lentelė
- Neorganinių junginių
santykinių molekulinių masių lentelė
- Medžiagų tirpalų tankių
lentelė
- Elektrinis neigiamumas pagal
Polingą
- Konstantos
- Metalų reaktingumo eilė
Žinynas atveriamas pasirinkus nuorodą: Žinynas
Žinynas
Toliau pateikiamas Žinyne esančios informacijos pavyzdys:
Elektrinis neigiamumas pagal
Polingą

Teorija –
pateikiama
pagrindinė teorinė medžiaga: taisyklės, apibrėžimai, pavyzdžiai.
Pateikiame teorijos pavyzdį:
 Teorija
Teorija
Molis – medžiagos kiekio
vienetas,
kuriame yra tiek atomų, molekulių, jonų, kiek 12 g anglies 12C
izotopo. Jis žymimas raide n.
Pvz.:
Vandens tankis 20o C lygus 0,9982 g/ml. Vandens tankis 4o
C lygus 1 g/ml.
Formulės –
pateikiamos
skaičiavimams reikalingos formulės.
Pateikiame formulių pavyzdį:
 Formulės
Formulės
 |
m
–
masė
g kg |
Uždavinių pavyzdžiai –
pateikiami pagrindinių tipų uždavinių sprendimo pavyzdžiai.
Pateikiame pavyzdį:
 Uždavinių sprendimo pavyzdžiai
Uždavinių sprendimo pavyzdžiai
Uždavinys
1
Apskaičiuokite vandens masės dalį
CuSO4 x 5H2O.
Duota:Mr(H2O) =
18,
Mr(CuSO4 x
5H2O) = 250
Rasti:
w(H2O)
Formulė:
w(H2O) = iMr(H2O)
: Mr(hidrato) x 100 %
Sprendimas:
w(H2O) = 5 x 18
: 250 x 100 % =
36 %
Atsakymas:
vandens masės dalis –
36 %.
Uždaviniai –
tai
mokytojo paruoštos užduotys
savarankiškam darbui. Kiekvienam uždaviniui pateikiamas teisingas
atsakymas, tad galima pasitikrinti sprendimo teisingumą.
Pateikiame pavyzdį:
 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui
1.
Išmatavus 20,7 g sieros tūrį, jis yra 10
cm3. Raskite
sieros tankį.
Atsakymas
Kai kuriose temose rasite mintino
skaičiavimo uždavinių. Pavyzdžiui:
Mintino
skaičiavimo uždaviniai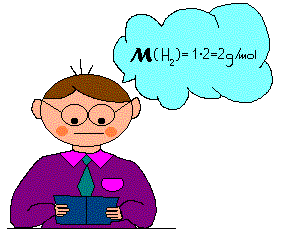
1. Kiek svers 10 cm3 ir 0,1 cm3 geležinės vinys? Geležies tankis –
7,87 g/cm3.
Atsakymas
Mintino skaičiavimo ir savarankiško
darbo uždavinių atsakymai pateikiami atskirame lange, kuris atveriamas
pasirinkus nuorodą Atsakymas.
Atsakymai šiame lange išdėstyti pagal temas. Pavyzdžiui:
Tankis
Nr.
|
Atsakymas
|
| 1. |
78,7 g
ir 0,787 g |
| 2. |
150 ml
ir 1000 ml |
| 3. |
nepakels,
stiklainis svers 135,5 kg |
Formulynas
Formulyne pateiktos visos uždavinių sprendimui
naudojamos formulės. Pavyzdžiui:

Tankis
Medžiagos tankis: ς
= m : v
ς
–
tankis –
g/cm3, g/ml, g/l,
kg/m3
Medžiagos masė: m
= v x ς
m –
masė –
g, kg
Medžiagos tūris: v
= m : ς
v –
tūris –
1ml
= 1cm3, 1l = 1dm3,
m3
Žodynėlis
Žodynėlyje paaiškinami pagrindiniai chemijos
terminai. Jie išdėstomi abėcėlės tvarka:
 A
C
D
H
J K
L
M
R
S
T
A
C
D
H
J K
L
M
R
S
T
Atomas –
mažiausia chemiškai nedaloma medžiagos
dalelė.
Atominis masės
vienetas – tai
dydis, lygus 1/12 anglies 12C
izotopo masės daliai.
Literatūra
Pateikiamas uždavinių sprendimo mokymosi
rekomenduojamos literatūros sąrašas. Tai vadovėliai ir uždavinynai:

-
R.H.Petrucci, W.S.Harwood. Bendroji chemija. Vilnius: Tvermė,
2000.
-
I.Merkienė, Chemijos uždavinynas. Vilnius:
Saulabrolis, 2000.
Kaip
mokytis?
Norėdami savarankiškai išmokti spręsti
chemijos uždavinius: