Atominė
masė, santykinė
molekulinė masė
 Teorija
Teorija
Atominė
masė
Atomas – chemiškai nedaloma medžiagos
dalelė.
Iš atomų sudaryti visi
elementai. Juos pasverti net pačiomis jautriausiomis svarstyklėmis
labai sunku. Jų masės neįmanoma išmatuoti įprastais masės
vienetais: gramais, kilogramais, tonomis.
Vandenilio masė:
ma(H) = 0, 000 000 000 000 000
000 000 000 001663 kg = 1,66 x 10 -27 kg = 1,66 x 10 -24 g.
Todėl buvo atrastas atominis masės
vienetas, kuris trumpinamas (a.m.v. arba a.v. arba
u.).
Jis lygus 1/12 anglies
izotopo 12C masės.
12C
izotopas parinktas todėl, kad labai stabilus.
Lygindami elemento masę su 1u.,
nustatome masės vertę, kuri vadinama santykine atomine mase,
žymima
Ar.
Ar rodo, kiek vienas elementas sunkesnis už
kitą.
Elementų santykine atomine mase
laikoma jo atomų vidutinė masė, apskaičiuota atsižvelgiant
į visų jo izotopų paplitimą gamtoje.
Santykinė
molekulinė masė
Molekulė
– daugumos medžiagų mažiausia dalelė, turinti visas
tos medžiagos savybes.
Medžiagos
santykinė molekulinė masė rodo, kiek kartų tos medžiagos
molekulės masė didesnė už 1a.m.v. arba 1u. Ji žymima
Mr. Tai bematis (bedimensinis dydis).
Santykinė molekulinė masė
(molekulinė masė) skaičiuojama sudedant elementų, įeinančių
į molekulės sudėtį, santykines atomines mases. Jei molekulėje
yra keli tos pačios rūšies atomai, reikia atominę masę
padauginti iš atomų skaičiaus. Atominės masės
apvalinamos iki sveikojo skaičiaus.
 Uždavinių sprendimo pavyzdžiai
Uždavinių sprendimo pavyzdžiai
Uždavinys
1
Raskite šių molekulių
santykines molekulines mases: O2, NO, H2SO4.
Sprendimas:
Mr(O2) = 16 x 2 =
32
Mr(NO) = 14 + 16 = 30
Mr(H2SO4)
= 1 x 2 + 32 + 16 x 4 = 98
Atsakymas: Mr(O2)
– 32, Mr(NO)
– 30, Mr(H2SO4)
– 98.
 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui
1.
Suskaičiuokite
šių medžiagų santykines molekulines mases: HCl, HNO3, CO2, C6H12O6.
Atsakymas

Molis
 Teorija
Teorija
Labai svarbu žinoti, kiek atomų,
molekulių, jonų dalyvavo reakcijoje ir kiek jų susidarė.
Šias mažas dalelias yra be galo sunku suskaičiuoti, todėl
buvo nutarta medžiagos kiekį matuoti moliais.
Molis – medžiagos kiekio vienetas,
kuriame yra tiek atomų, molekulių, jonų, kiek 12g anglies 12C
izotopo. Jis žymimas raide n. Tai SI sistemos vienetas.
Apibrėžime minimos struktūrinės
dalelės – atomai, molekulės, jonai. Jų skaičius,
sudarantis vieną molį, vadinamas Avogadro skaičiumi
ir žymimas
NA. Vieno molio anglies- 12 masę padaliję iš vieno
anglies – 12 atomo masės gramais, randame Avogadro konstantos vertę.
N = anglies 12C vieno molio masė: anglies 12C vieno atomo masė = 12,00000 g/mol: 1,992648 x 10-23
g
= 6,022137 x 1023 mol -1
Sprendžiant uždavinius konstanta
apvalinama iki 6,022 x 1023mol-1
arba 6,02 x 1023mol-1. Viename molyje
įvairių medžiagų yra vienodas skaičius, t.y. 6,02 x 1023.
Pvz.: 1 mol O2 (deguonies)
molekulių yra 6,02 x 1023
1 mol CO2 (anglies dioksido) molekulių yra 6,02 x 1023
Vienoje deguonies O2 molekulėje
yra 2 mol deguonies atomų, taigi atomų bus 2 x 6,02 x 1023.
Viename molyje CO2 (anglies dioksido) yra 1 mol C atomų, t.y.
6,02 x 1023 ir 2 mol O atomų, t.y. 2 x 6,02 x 1023.
 Formulės
Formulės

 Uždavinių sprendimo pavyzdžiai
Uždavinių sprendimo pavyzdžiai
Uždavinys
1
Kiek molių sudaro 12,04 x 1023
anglies dioksido molekulių?
Duota:
N(CO2) = 12,04 x 1023
NA = 6,02 x 1023
Rasti:
n
Formulė:
n = N : NA
Sprendimas:
n(CO2) = 12,04 x 1023
molek. : 6,02 x 1023 molek/mol = 2 mol
Atsakymas:
sudaro – 2 mol CO2
molekulių.
Uždavinys
2
Kiek atomų yra 0,5 mol geležies?
Duota:
n(Fe) = 0,5 mol
N A = 6,02 x 1023
Rasti:
N(Fe)
Formulė:
N = n x NA
Sprendimas:
N(Fe) = 0,5 mol x 6,02 x
1023 atomų/mol
= 3,01 x 1023 atomų
Atsakymas: 3,01 x 1023 Fe
atomų.
 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui
1. Kiek
molių sudarys 18,06 x 1023
deguonies molekulių?
Atsakymas
2. Kiek
molių užima 1,204 x 1023 vario atomų?
Atsakymas
3. Kiek
molių sudaro 6,02 x 1022 anglies dioksido molekulių?
Atsakymas
4. Kiek
molių sudaro 1,204 x 1024 anglies atomų?
Atsakymas
5. Raskite
0,65 mol chloro molekulių skaičių.
Atsakymas
6. Raskite
4 mol anglies monoksido molekulių skaičių.
Atsakymas
7. Kiek
magnio atomų yra 0,1 mol mėginyje?
Atsakymas
8. Kur
daugiau struktūrinių dalelių: 0,15 mol anglies ar tokiame pačiame
kiekyje chloro? Įvardinkite struktūrines daleles ir nustatykite jų
skaičių.
Atsakymas

Molinė
masė
 Teorija
Teorija
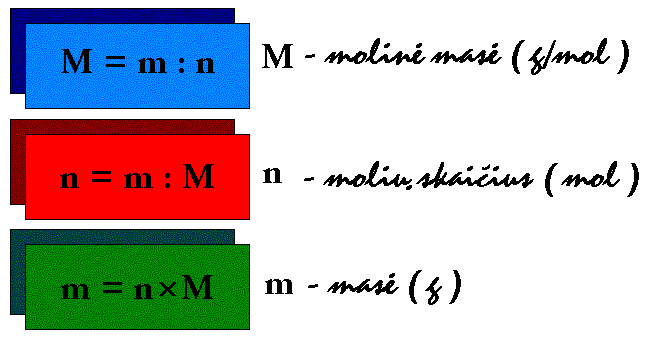
Molių skaičius randamas žinant medžiagos masę bei molių masę.
Vieno medžiagos molio masė
vadinama moline mase. Ji žymima M. Molinės masės matavimo
vienetas yra g/mol.
 Formulės
Formulės
 Uždavinių sprendimo pavyzdžiai
Uždavinių sprendimo pavyzdžiai
Uždavinys
1
Raskite vandenilio chlorido HCl 3 molių
masę.
Duota:
n(HCl) = 3 mol
M(HCl) = 1 + 35,5 = 36,5 g/mol
Rasti:
m(HCl)
Formulė:
m = n x M
Sprendimas:
m(HCl) = 3 mol x 36,5 g/mol = 109,5
g.
Atsakymas:3
mol HCl sveria 109,5 g.
Uždavinys
2
 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui
1. Kiek
svers 1,5 mol vandens?
Atsakymas
2.
Kokia
0,25 mol azoto monoksido masė?
Atsakymas
3.
Kas
svers daugiau: 0,25 mol azoto (N2) ar toks pats kiekis anglies
dioksido (CO2)?
Atsakymas
4.
Kokia 1,25 mol sieros rūgšties (H2SO4) ir
1,20 mol
natrio chlorido masė (NaCl)?
Atsakymas
5.
Ar
vienodai svers 0,5 mol geležies (Fe) ir 0,438 mol vario? Raskite vienetų
tikslumu.
Atsakymas
6.
Kiek
molių sudaro 126 g azoto rūgšties?
Atsakymas
7.
Kiek
molių sudaro 20 g sieros trioksido (SO3)?
Atsakymas
8.
Ar
vienodas yra 16 g SO2 (sieros dioksido) ir 24,5 g sieros rūgšties
(H2SO4) molių skaičius?
Atsakymas
9.
Kiek
molių sudarys: 5,5 g anglies dioksido (CO2), 10,5 g azoto rūgšties
(HNO3)?
Atsakymas
10.
Kuri
medžiaga sudaro daugiau molių: 20,2 g kalio salietros (KNO3)
ar 21,25 g natrio salietros (NaNO3)?
Atsakymas
11.
Kokioje masėje ir kiekyje azoto (IV) oksido NO2 yra tiek, kiek
jo yra a) 1,5 mol NH3, b) 1,5 mol NH4NO3,
c) 2 mol Ca (NO3)2?
Atsakymas

Molinis
dujų tūris
 Teorija
Teorija
Dujos neturi pastovios formos, jas galima
suspausti, lengvai pakeisti tūrį. Dujose atstumai tarp molekulių
yra labai dideli. Skirtingų dujų 1
l tomis pačiomis sąlygomis,
esant 0o C temperatūrai ir 1,013 x 105 Pa slėgio,
masė yra skirtinga. Šios sąlygos vadinamos
normaliomis sąlygomis (n.s.).
Nors dujų ir masės
skirtingos, 1 mol jų užima tą patį 22,4
l (n.s.) tūrį.
VM : 1
l = M
: m, kur VM
– molinis dujų tūris, m – 1
l dujų masė, M – dujų
molinė masė.
Raskime deguonies molinį dujų tūrį:
m(O2)
= 1,428 g, M(O2) = 31,999 g/mol
VM = 31,999 g/mol x 1
l
:
1,428 g
= 22,4 l/mol
Taip galima suskaičiuoti įvairių
dujų molinį tūrį, kuris bus 22,4
l/mol.
Tūris, kurį užima
1 mol bet
kokių dujų, esnt Oo C temperatūrai ir 1,013 x
105
Pa slėgiui, vadinamas moliniu dujų tūriu. Jis lygus 22,4
l.
Šiame tūryje molekulių yra 6,02 x 1023.
Taigi, jei medžiagos agregatinė
būsena dujinė, skaičiuojant medžiagos kiekį mol, galima
pasitelkti tūrį.
 Formulės
Formulės

 Uždavinių sprendimo pavyzdžiai
Uždavinių sprendimo pavyzdžiai
Uždavinys
1
Kiek molių sudaro 44,8
l metano (CH4)?
Duota:
V(CH4) = 44,8
l
VM = 22,4
l/mol
Rasti:
n(CH4)
Formulė:
n = V : VM
Sprendimas:
n(CH4) = 44,8
l : 22,4
l/mol =
2mol.
Atsakymas: 2
mol CH4.
Uždavinys
2
Mintino
skaičiavimo uždaviniai
1. Raskite santykinę molekulinę
masę vandenilio H2, azoto N2 ir vandens H2O.
Atsakymas
2.
Kiek
svers 4 moliai pirmame uždavinyje naudotų medžiagų?
Atsakymas
3.
Ar
vienodas molekulių skaičius 4 moliuose jau minėtų medžiagų?
Atsakymas
4.
Kokį
tūrį užims n.s. 0,1 mol, 1 mol, 10 mol amoniako NH3?
Atsakymas
 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui
1. Kiek
molių sudarys 89,6
l vandenilio (H2)?
Atsakymas
2. Kiek
molių sudarys 2,8
l azoto (N2)?
Atsakymas
3.
Koks molių skaičius 11,2
l deguonies (O2),
11,2
l vandenilio? Ar
jis vienodas?
Atsakymas
4.
Kiek
molių sudaro 33,6
l acetileno (C2H2) ir 39,2
l
etileno (C2H4)?
Atsakymas
5.
Kas
sudaro daugiau molių: 4,48
l smalkių (CO) ar 5,6
l anglies
dioksido? Raskite ir abiejų medžiagų molių skaičių.
Atsakymas
6.
Koks
tūris yra 2 mol fluoro (F2)?
Atsakymas
7.
Kokį
tūrį užima 0,35 mol chloro (Cl2)?
Atsakymas
8.
Ar
vienodą tūrį užims 0,45 mol anglies monoksido (CO) ir
toks pat kiekis azoto monoksido (NO)? Raskite abiejų medžiagų
tūrius.
Atsakymas
9.
Kokius
tūrius užims 0,55 mol anglies dioksido (CO2) ir 0,65 mol
azoto dioksido (NO2)?
Atsakymas
10.
Kuri
medžiaga užima didesnį tūrį: 1,1 mol vandenilio (H2) ar 1,2 mol vandenilio chlorido (HCl)?
Atsakymas
11.
Kiek molių, molekulių ir koks tūris (n.s.) deguonies (O2)
išsiskirs skaidant 150 g vandenilio peroksidą
(H2O2)?
Atsakymas
12.
Koks tūris vandens (H2O) suskaidytas elektros srove, kai
susidarė 14
l
vandenilio (n.s.)?
Atsakymas

 Uždaviniai savarankiškam darbui
Uždaviniai savarankiškam darbui